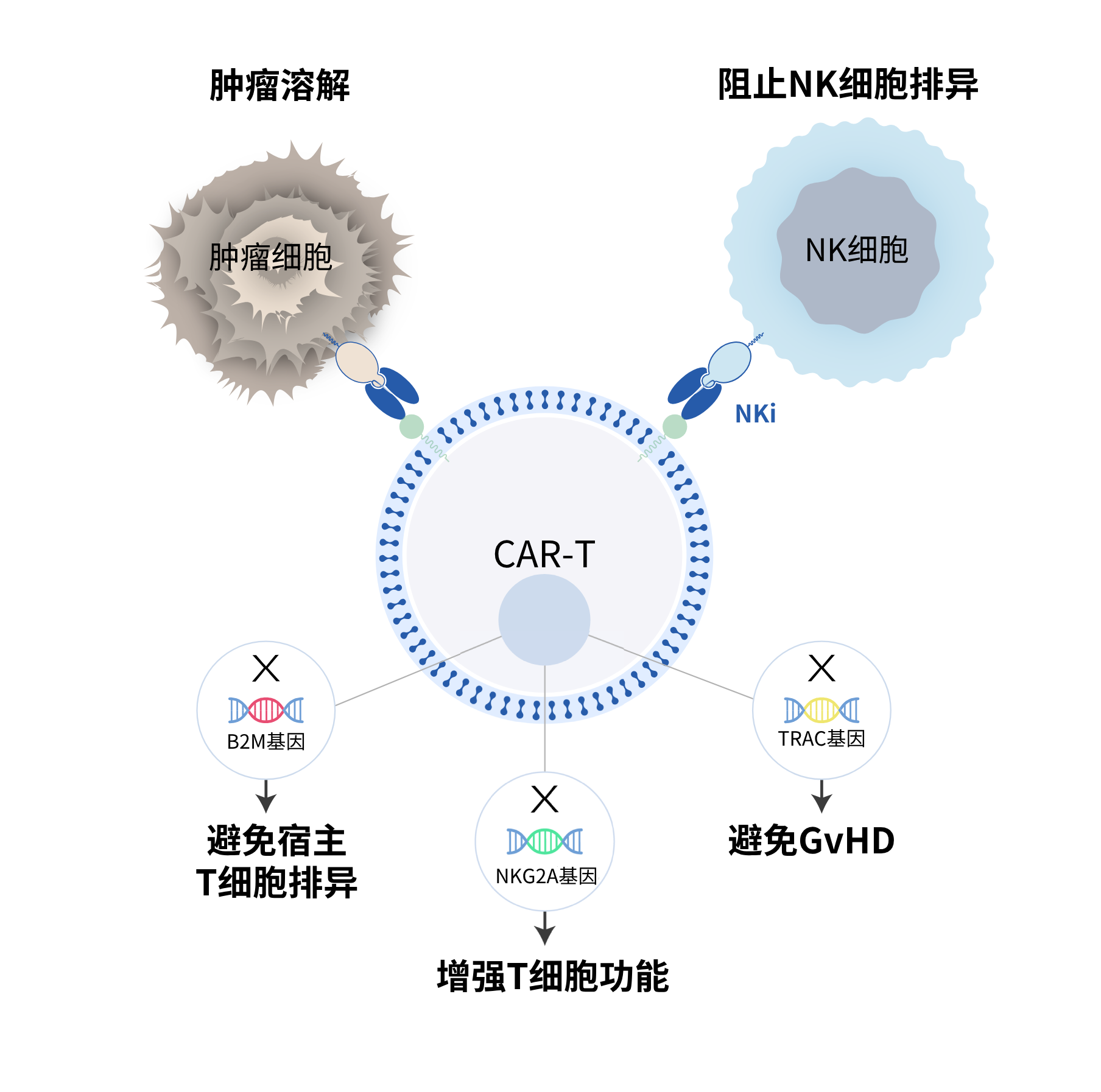
THANK-uCAR®
为了避免宿主T细胞对于同种异体CAR-T细胞的排异,通常会敲除B2M基因。但是,缺乏B2M基因的同种异体CAR-T细胞会被宿主的NK细胞排异,导致同种异体CAR-T细胞的增殖和持久性降低。
为了解决这个问题,一种识别NK细胞表面蛋白-NKG2A的CAR被装载到同种异体CAR-T细胞中,以阻止宿主NK细胞的攻击,这就是THANK(Target to Hinder the Attack of NK细胞)-uCAR 技术。我们的数据表明,在NK细胞存在的情况下,THANK-uCAR® T 细胞比TCR/B2M双敲除同种异体T细胞能更好地存活和增殖。
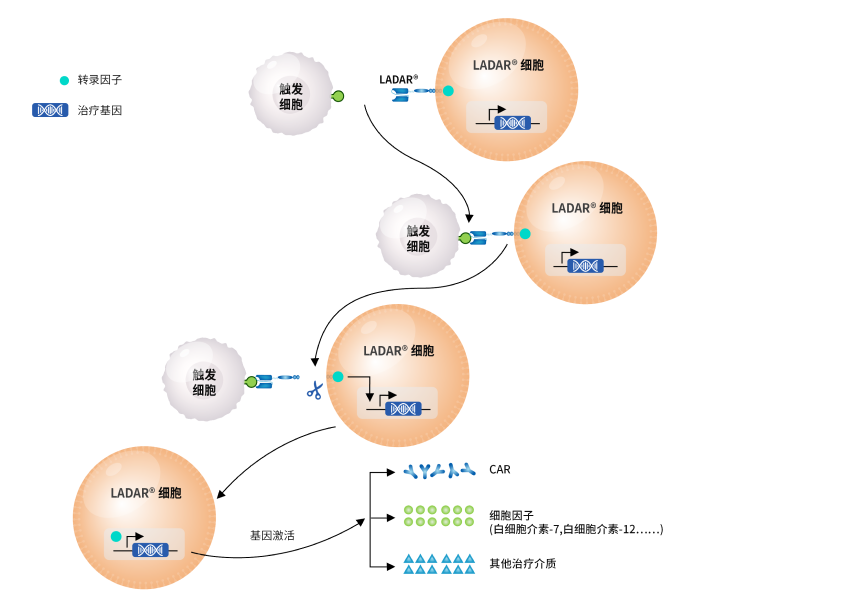
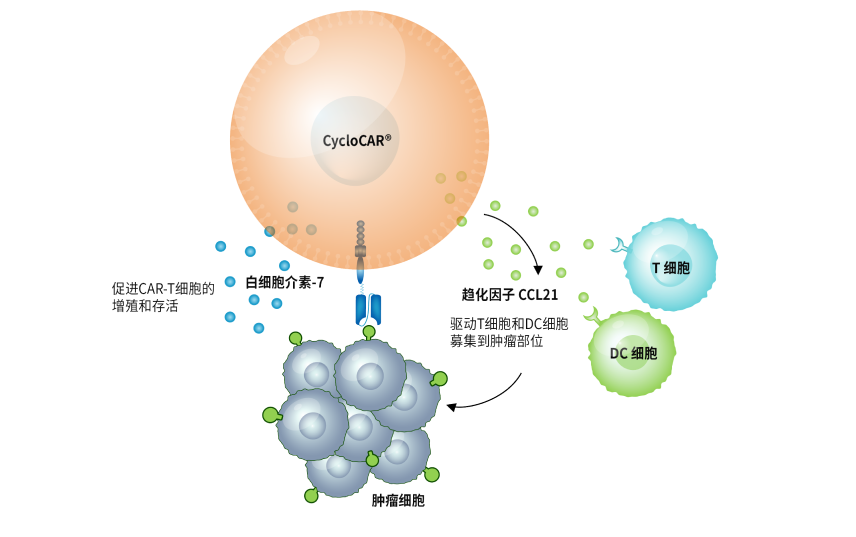
LADAR®
大多数肿瘤相关抗原也在正常组织中表达,这对包括免疫细胞疗法在内的靶向治疗的发展提出了巨大挑战。为了解决靶向可用性方面的挑战,我们继续探索创新技术,以提高药物靶点可用性,从而使不可成药的靶点成为可成药靶点。我们开发了LADAR®技术,其中目标基因的细胞内转录由一个人工受体控制,该受体在细胞内结构域中含有转录因子。一旦LADAR®受体的胞外结构域与触发抗原(发送者抗原)结合,转录因子就会被切割并转移到细胞核,从而触发目标基因的表达。感兴趣的基因可能是嵌合抗原受体(CAR)、细胞因子或任何需要的治疗介质。
LADAR-CAR通路需要用于LADAR®的发送者抗原和用于CAR识别的目标抗原的同时存在,以杀死目标细胞,从而减少在同一正常组织中不同时表达这两种抗原的在靶脱瘤毒性。在我们的体外研究中,LADAR®系统诱导了强烈的基因表达,以响应触发抗原的结合,重要的是,在没有触发抗原的情况下几乎没有泄漏表达。
我们还在研究LADAR®系统的其他应用,例如LADAR®细胞因子通路。我们相信,LADAR®系统是开发CAR-T细胞的强大工具,可以降低在靶脱瘤毒性并扩大靶向可用性。此外,它还可望应用于细胞因子和其他治疗介质的精准输送。